Segunda ley de la termodinámica.
La segunda ley de la termodinámica
Nicolás Léonard Sadi Carnot (1796 - 1832) fue hijo de Lazare Carnot, conocido como el Gran Carnot, y tío de Marie François Sadi Carnot, que llegó a ser Presidente de la República Francesa. Sadi Carnot fue un ingeniero y oficial de la milicia francesa y es el pionero y fundador en el estudio de la Termodinámica.Hay quienes conceden a Sadi Carnot ser el padre de la Termodinámica, pero su condición de ingeniero indigna a algunos físicos quienes dan la paternidad de la Termodinámica a William Thomson (Lord Kelvin) y a Plank, inclusive se menciona que el concepto de Ciclo Carnot quizá viene de la influencia de Emile Clapeyron quien en 1834 analizó y realizó gráficos del ensayo de Sadi Carnot.
Licenciado en la Escuela Politécnica, en 1824 publicó Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en donde expuso los dos primeros principios de la termodinámica. Estos trabajos, poco comprendidos, inclusive despreciados por la comunidad científica (algunos físicos prominentes) de la época, fueron más tarde conocidos en Alemania por Rudolf Clausius, que fue quien los difundió y William Thomson (lord Kelvin) quien hizo lo propio en el Reino Unido. Cabe mencionar que el ensayo de Carnot fue recogido por Clausius y Thompson para formular de una manera matemática, las bases de la termodinámica.
Como reconocimiento a las aportaciones pioneras, el principio de Carnot se rebautizó como principio de Carnot-Clausius. Este principio permite determinar el máximo rendimiento de una máquina térmica en función de las temperaturas de su fuente caliente y de su fuente fría. Cuando Luis XVIII envió a Carnot a Inglaterra para investigar el elevado rendimiento de sus máquinas de vapor, se dio cuenta que la creencia generalizada de elevar la temperatura lo más posible para obtener el vapor mejoraba el funcionamiento de las máquinas. Poco después descubrió una relación entre las temperaturas del foco caliente y frío y el rendimiento de la máquina. Como corolario se obtiene que ninguna máquina real alcanza el rendimiento teórico de Carnot (obtenido siguiendo el ciclo de Carnot), que es el máximo posible para ese intervalo de temperaturas. Toda máquina que sigue este ciclo de Carnot es conocida como máquina de Carnot.
Sadi Carnot no publicó nada después de 1824 y es probable que él mismo creyera haber fracasado. Su pensamiento es original, único en la historia de la ciencia moderna, pues a diferencia de lo que le sucede a muchos otros científicos, no se apoya en nada anterior y abre un amplio campo a la investigación.
 a otro estado final
a otro estado final 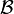 , el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
, el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
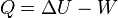
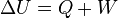
 es la variación de energía del sistema,
es la variación de energía del sistema,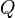 es el calor intercambiado por el sistema a través de unas paredes bien definidas, y
es el calor intercambiado por el sistema a través de unas paredes bien definidas, y

